TWIK1 : un canal potassique spécifique à l’étude pour le développement de stratégies thérapeutiques contre l’accumulation neuronale de fer
Dans leurs précédents travaux, les chercheurs du projet ANR DynaSelect ont montré que le canal TWIK1 peut passer d’un état inhibiteur à un état excitateur, simplement en passant d’un état sélectif pour l’ion potassium à un état perméable au sodium lorsqu’il est soumis à un pH acide. Ce phénomène est responsable de la dépolarisation paradoxale des cardiomyocytes humains dans l'hypokaliémie pathologique, et peut contribuer aux arythmies cardiaques. Les chercheurs ont donc étudié plus précisément les conséquences physiologiques de la sélectivité dynamique du canal TWIK1, sur la fonction cardiaque, la fonction rénale, ou l’excitabilité cellulaire notamment.
Le rôle de TWIK1 dans le métabolisme du fer
Pour cela, ils ont mené une analyse phénotypique de souris génétiquement modifiées par une approche CrispR-Cas9, dans lesquelles le canal TWIK1 est soit bloqué dans l’état sélectif au potassium (souris KIK), soit bloqué dans l’état perméable au sodium (souris KINa). Ils ont également étudié des souris qui n’expriment plus le canal TWIK1 (souris KO). 17 à 19 jours après la naissance, les souris KIK et KO présentaient une alopécie transitoire (perte de poils), un phénotype particulier associé à un métabolisme défectueux en fer. Les souris KINa ne présentaient pas ce phénotype, ce qui suggère que l’état perméable au sodium de TWIK1 est nécessaire pour prévenir la perte des poils à ce stade de développement. D’autres observations ont confirmé le rôle de TWIK1 dans le métabolisme du fer.
Les chercheurs émettent l'hypothèse que la perméabilité au sodium de TWIK1 accélère l'acidification vésiculaire et la libération du fer. Le blocage de TWIK1 pourrait être une option intéressante pour réduire l’accumulation de fer, car les souris TWIK1 KI ou KO adultes ne présentent aucune anémie à l’âge adulte.
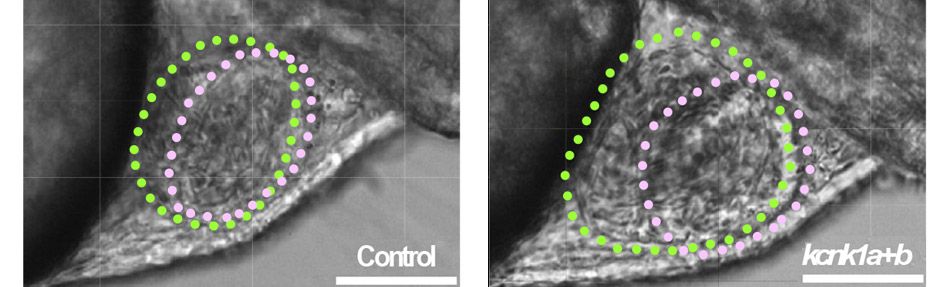
Un canal nécessaire au développement et au fonctionnement cardiaque du poisson zèbre
Les chercheurs ont également étudié l’impact physiologique de TWIK1 sur la fonction cardiaque du poisson zèbre qui, comme l’Homme, exprime TWIK1 dans son myocarde contrairement à la souris. Le poisson zèbre possède 2 orthologues de TWIK1, kcnk1a et kcnk1b, avec les mêmes propriétés que le canal TWIK1 humain, notamment la sélectivité ionique dynamique et un recyclage actif par le système endosomal.
 Afin d’évaluer le rôle de ces canaux dans le développement et la physiologie cardiaques, ils ont inactivé l’expression de ces deux canaux en injectant des morpholinos, puis ils ont étudié les larves de ces poissons zèbres (KO). Leurs résultats (Christensen AH et al. ; J Mol Cell Cardiol. 2016) montrent que l’inactivation de TWIK1 provoque une malformation cardiaque et des arythmies chez le poisson zèbre. Une fonction normale est restaurée en exprimant le canal humain dans ce tissu. La prochaine étape sera d’exprimer dans ces poissons zèbre KO des formes du canal humain bloquées dans l’état sélectif au potassium ou dans l’état perméable au sodium, afin d’évaluer le rôle de la sélectivité ionique dynamique de TWIK1 dans la fonction cardiaque.
Afin d’évaluer le rôle de ces canaux dans le développement et la physiologie cardiaques, ils ont inactivé l’expression de ces deux canaux en injectant des morpholinos, puis ils ont étudié les larves de ces poissons zèbres (KO). Leurs résultats (Christensen AH et al. ; J Mol Cell Cardiol. 2016) montrent que l’inactivation de TWIK1 provoque une malformation cardiaque et des arythmies chez le poisson zèbre. Une fonction normale est restaurée en exprimant le canal humain dans ce tissu. La prochaine étape sera d’exprimer dans ces poissons zèbre KO des formes du canal humain bloquées dans l’état sélectif au potassium ou dans l’état perméable au sodium, afin d’évaluer le rôle de la sélectivité ionique dynamique de TWIK1 dans la fonction cardiaque.
Des canaux TWIK1 photosensibles pour étudier le courant du canal
Différents canaux TWIK1 sensibles à la lumière ont par ailleurs été produits pour étudier les relations structure/fonction du canal. Les observations montrent que seul le courant potassium est inhibé par la lumière, tandis que le courant sodium est insensible. Cela suggère que ces deux ions n’empruntent pas les mêmes voies de conduction au sein du canal. Les chercheurs poursuivront leurs analyses pour mesurer la conductance unitaire, la probabilité d’ouverture et la sélectivité ionique en fonction des ions transportés.
Ces travaux montrent in vivo que TWIK1 n’est pas un canal potassium classique mais que son état perméable au sodium joue un rôle physiologique. Ils ouvrent de nouvelles perspectives sur l’étude de l’excitabilité cellulaire dans le cœur et le cerveau. La modulation de TWIK1 par des agents pharmacologiques pourrait constituer une nouvelle approche thérapeutique, notamment contre l’accumulation de fer dans les maladies neurodégénératives.
Le projet ANR DynaSelect (2014 – 2019)
Le projet Dynaselect est un projet de recherche fondamentale coordonné par Florian Lesage (IPMC CNRS) associant l’institut de Biologie Valrose (iBV) et le Laboratoire de PhysioMédecine Moléculaire (LP2M).
Références :
Christensen AH, Chatelain FC, Huttner IG, Olesen MS, Soka M, Feliciangeli S, Horvat C, Santiago CF, Vandenberg JI, Schmitt N, Olesen SP, Lesage F, Fatkin D. The two-pore domain potassium channel, TWIK-1, has a role in the regulation of heart rate and atrial size. J Mol Cell Cardiol. 2016, Aug;97:24-35
Chatelain FC., Bichet D., Douguet D., Feliciangeli S., Bendahhou S., Reichold M., Warth R., Barhanin J. and Lesage F. (2012). TWIK1, a unique background channel with variable ion selectivity. Proc Natl Acad Sci U S A, 109 (14) : 5499-5504
Feliciangeli S., Bendahhou S., Sandoz G., Gounon P., Reichold M., Warth R., Lazdunski M., Barhanin J. and Lesage F. (2007). Does Sumoylation Control K2P1/TWIK1 Background K+ Channels? Cell, 130 (3) : 563-9


