Deux systèmes haut-débit novateurs pour le diagnostic et la découverte d'anticorps thérapeutiques : le projet ANR DROP-mAbs

Les cellules sécrétrices d'anticorps sont des cellules rares qui résident majoritairement dans des compartiments anatomiques liés à l’immunité (rate, ganglions, moelle osseuse) et représentent une ressource de choix pour la sélection d’anticorps de forte affinité pour un antigène, à des fins thérapeutiques ou de diagnostic. Il est cependant difficile avec les méthodes actuelles (technologie des hybridomes, phage display) de déterminer rapidement la cible des anticorps qu’elles sécrètent, leur séquence, leur vitesse de sécrétion, et l’affinité des interactions anticorps-cible. Des développements sont nécessaires en vue d’intégrer dans les futures technologies, la capacité de relier l'affinité de l’anticorps sécrété pour l’antigène (phénotype) aux séquences des gènes VH-VL appariés qui déterminent la spécificité de l'anticorps (génotype).
Une stratégie associant la microfluidique en gouttes et le séquençage haut-débit
Dans le cadre du projet ANR DROP-mAbs (2014-2019) coordonné par Pierre Bruhns (Institut Pasteur / Inserm), les chercheurs ont décrit deux méthodologies basées sur la microfluidique en gouttes, la microscopie et le séquençage de nouvelle génération.
 Le premier système, nommé DropMap, permet de déterminer l'affinité des anticorps sécrétés par des cellules individuelles pour un antigène, et ce pour des dizaines de milliers de cellules en même temps dans un court laps de temps (quelques heures). Les cellules sont compartimentées dans des gouttelettes microfluidiques avec un bio-essai permettant de mesurer l'affinité de l'anticorps sécrété. Les chercheurs ont utilisé ce système pour caractériser la réponse anticorps chez les souris immunisées contre l'anatoxine tétanique, sur un protocole de 7 semaines, et ont réalisé une analyse quantitative et statistique de la répartition des taux de sécrétion et des affinités au cours de la réponse immunitaire. Cette étude a été réalisée sur des prélèvements de rate et de moelle osseuse des mêmes souris, permettant d’établir une « carte anatomique » de la réponse anticorps.
Le premier système, nommé DropMap, permet de déterminer l'affinité des anticorps sécrétés par des cellules individuelles pour un antigène, et ce pour des dizaines de milliers de cellules en même temps dans un court laps de temps (quelques heures). Les cellules sont compartimentées dans des gouttelettes microfluidiques avec un bio-essai permettant de mesurer l'affinité de l'anticorps sécrété. Les chercheurs ont utilisé ce système pour caractériser la réponse anticorps chez les souris immunisées contre l'anatoxine tétanique, sur un protocole de 7 semaines, et ont réalisé une analyse quantitative et statistique de la répartition des taux de sécrétion et des affinités au cours de la réponse immunitaire. Cette étude a été réalisée sur des prélèvements de rate et de moelle osseuse des mêmes souris, permettant d’établir une « carte anatomique » de la réponse anticorps.
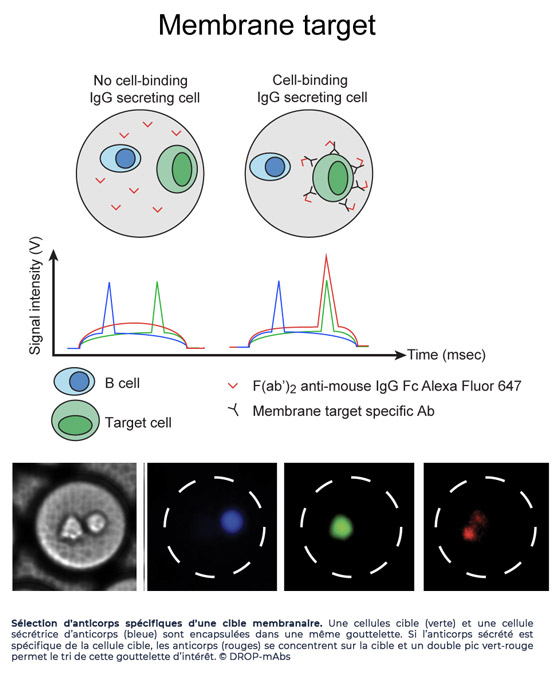 Le second, nommé CelliGOTM, permet de trier les cellules qui sécrètent des anticorps spécifiques d’un antigène et de séquencer leurs gènes VH-VL appariés avec une efficacité supérieure à 93%, via une approche de séquençage haut-débit couplée à une analyse bio-informatique, pour obtenir des répertoires d’anticorps de cellules sécrétrices d'anticorps. Ce processus utilise le même bio-essai que pour DropMap et a permis une caractérisation efficace et rapide de cellules B spécifiques de trois antigènes, l’anatoxine tétanique, un autoantigène protéique soluble et un antigène de membrane (cible thérapeutique anti-cancéreuse).
Le second, nommé CelliGOTM, permet de trier les cellules qui sécrètent des anticorps spécifiques d’un antigène et de séquencer leurs gènes VH-VL appariés avec une efficacité supérieure à 93%, via une approche de séquençage haut-débit couplée à une analyse bio-informatique, pour obtenir des répertoires d’anticorps de cellules sécrétrices d'anticorps. Ce processus utilise le même bio-essai que pour DropMap et a permis une caractérisation efficace et rapide de cellules B spécifiques de trois antigènes, l’anatoxine tétanique, un autoantigène protéique soluble et un antigène de membrane (cible thérapeutique anti-cancéreuse).
Des systèmes modulables d’intérêt pour la surveillance immunitaire
Le bio-essai peut être adapté pour cribler d’autres activités des anticorps (réactivité croisée, induction de signalisation intracellulaire, induction d’endocytose, opsonisation), mais aussi pour cribler d’autres cellules, telles que les cellules T, sécrétant différentes molécules (les cytokines par exemple). Dans le cadre du système DropMap, il pourrait être utilisé pour la surveillance immunitaire durant une pathologie ou un protocole thérapeutique, l'optimisation de protocoles d'immunisation/vaccination et, via l'optimisation de l'immunisation, le choix de l'organe lymphoïde et le moment de la récolte des cellules B, facilitent la production d'anticorps monoclonaux de haute qualité. Dans le cadre du système CelliGOTM, il devrait faciliter l'identification d'anticorps ayant des activités fonctionnelles uniques à des fins thérapeutiques, en particulier sur des cibles difficiles comme les antigènes membranaires insolubles. La possibilité d’introduire différents antigènes ou des cellules cibles dans le bio-essai permet de trier les cellules sécrétrices d’anticorps d’intérêt directement pour une fonction souhaitée, et non plus seulement pour la capacité à fixer un antigène donné.
Les systèmes DropMap et CelliGOTM ont fait l’objet de deux publications dans Nature Biotechnologies (respectivement : Eyer K, et al. Nature Biotechnology 2017 et Gérard A, et al. Nature Biotechnology 2020), et ont donné lieu à deux brevets.
Le projet DROP-mAbs regroupe trois partenaires : l’Unité des Anticorps en Thérapie et Pathologie (UMR INSERM 1222, Institut Pasteur, Paris), l’entreprise HiFiBio Therapeutics, et le Laboratoire de Biochimie (UMR CNRS 8231, ESPCI, Paris).
Références :
- K. Eyer et al., Single-cell deep phenotyping of IgG-secreting cells for high resolution immune monitoring. Nature Biotechnology. 2017 Oct; 35(10):977-982. doi: 10.1038/nbt.3964
- Gérard A, et al. High-throughput Single-Cell Activity-Based Screening and Sequencing of Antibodies Using Droplet Microfluidics. Nature Biotechnology. 2020 Jun;38(6):715-721. doi: 10.1038/s41587-020-0466-7


